Турция увеличила импорт природного газа в январе 2024 году
30.03.2024
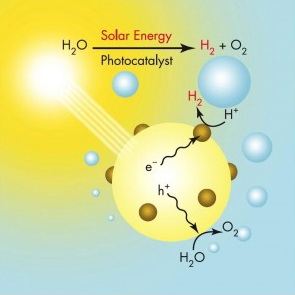
Солнечный свет – неисчерпаемый источник энергии, по-настоящему эффективно использовать который умеет пока что только природа (самым ярким тому примером является фотосинтез). И вот недавно исследователи из Массачусетского технологического института (MIT) в Кембридже впервые смогли приблизиться к созданию потенциально дешевых и практичных искусственных «листьев», позволяющих расщеплять воду на водород и кислород. Для нас это означает ни много ни мало потенциально неисчерпаемый источник легкодоступной энергии.
Новое устройство представляет собой кремниевую пластинку размером с игральную карту, покрытую с обеих сторон слоями двух различных катализаторов. Кремний поглощает солнечный свет и передает энергию катализаторам, которые, в свою очередь, используют ее для расщепления воды на молекулы водорода и кислорода.
Полученный водород – готовое топливо, которое можно либо сжигать, либо использовать в топливных элементах для производства электроэнергии, причем в любом случае на выходе мы снова получаем воду. Таким образом, теоретически устройство сможет стать источником дешевой, чистой и доступной энергии, для которого требуется наличие только лишь воды и солнца.
Презентация изобретения на заседании Американского химического общества (проходящего два раза в год) произвела неизгладимое впечатление на Роберта Грубса, химика из Калифорнийского технологического института в Пасадене. Отмечая необходимость доработки технологии для придания ей большей практичности он, тем не менее, подчеркивает значимость нового метода, так как «потенциально низкая стоимость может поспособствовать его широкому распространению».
В целом идея использования полупроводника для расщепления воды отнюдь не нова. Более десяти лет назад группа под руководством Джона Тернера из Национальной лаборатории возобновляемых источников энергии в Голдене, Колорадо, создала чип (тонкую пластинку) из арсенида галлия, способный расщеплять воду, сохраняя, в конечном счете, 12% энергии солнечного света в виде водорода. Однако арсенид галлия – довольно дорогой материал, а при длительном контакте с водой устройство ржавеет, становясь непригодным для использования.
Расщепление воды на составные части (водород и кислород) требует одновременного протекания двух химических реакций. Сперва из атомов водорода в воде удаляются электроны. Как результат, молекула воды распадается на положительно заряженные ионы водорода, или протоны, и отрицательно заряженные атомы кислорода. Затем один из катализаторов должен способствовать образованию связи между двумя атомами кислорода для получения О2, в то время как другой катализатор связывает два атома водорода с двумя электронами для создания H2.
Три года назад команда во главе с химиком Дэниелом Носера из Массачусетского технологического института частично решила эту проблему, задействовав в процессе формирования молекул O2 специальный катализатор на основе кобальта и фосфора. Уникальность катализатора заключалась в его способности растворяться и преобразоваться в ходе каталитического цикла. По словам Носера, это оказалось огромным преимуществом. Тем не менее, катализатор устройства, получившего название электролизёр, оказался также подвержен коррозии. Имелись и другие препятствия для использования подобного метода связывания атомов водорода. Для него хорошо подходила платина – опять-таки редкий и дорогой материал.
В 2009м году Носера с коллегами создали компанию Sun Catalytix для извлечения прибыли из производства электролизеров. Осенью компания получила дополнительное финансирование от индийского промышленного гиганта Tata. Получив к тому же $4 млн. долл. США от Управления перспективных научных исследований (ARPA-E), исследователи начали работу над устройством второго поколения.
И вот на днях Носера сообщил о разработке дешевого катализатора, в котором для формирования H2 используются сразу три различных металла, что позволяет обойти проблему с платиной. Состав нового катализатора пока неизвестен, так как работа все еще не опубликована и находится на стадии патентирования.
Со слов Носера стало известно, что три металла имеют различные функции. Первый, как активный ингредиент в препарате, соединяет молекулы Н2. Второй изначально предназначен для удержания двух других металлов в обрабатываемом сплаве. После нанесения сплава на поверхность в результате контакта с водой второй металл растворяется, оставляя два прочих металла внутри пористого материала. Это позволяет увеличить площадь поверхности для протекания реакции H2.
В обычных условиях эта реакция быстро затухает благодаря наличию фосфат-ионов. Для выведения фосфата с поверхности материала команда Носера и добавила третий металл, обеспечивший, таким образом, непрерывное функционирование устройства.
Для создания искусственного листа команда MIT нанесла катализаторы на противоположные стороны кремниевой пластинки. Кремний поглощает солнечный свет и передает активные отрицательно заряженные электроны и положительно заряженные электронные вакансии катализаторам на противоположных сторонах для формирования Н2 и О2.
На самом деле солнечный коллектор, конечно, представляет собой нечто более сложное, чем сплошная плитка кремния. Это просто необходимо, поскольку напряжение, необходимое для расщепления воды, составляет, по меньшей мере, в 1,23 вольт, в то время как одни кремниевый элемент обеспечивает лишь 0,5 вольт.
Потому команда Массачусетского технологического института использовала коммерчески доступный материал, состоящий из трех слоев кремниевых элементов, что дало им достаточное напряжение для возбуждения реакции расщепления воды. При помещении устройства в прозрачную емкость обеспечении доступа солнечного света оно производит постоянный поток кислорода и водорода, прорывающийся (восходящий) к поверхности. По словам Носера, установка преобразовывает 5,5% энергии солнечного света в водородное топливо (со временем исследователи надеются еще повысить эффективность и срок службы устройства).
Новый катализатор оказался также весьма стабильным. Команда исследователей в течение недели тестировала устройство, используя воду из близлежащей реки Чарльз в Кембридже, и за это время не заметила какого-либо снижения эффективности его работы. Осталось выяснить, сможет ли устройство так же эффективно работать и в морской воде. Если да, то это могло бы существенно снизить стоимость производства водородного топлива. Представители компании планируют еще несколько лет продолжать исследования, до начала же серийного производства пройдет еще от трех до пяти лет. В конечном итоге «искусственные листья обещают стать недорогим источником электричества для жителей бедных и развивающихся стран».
Технологии 08.04.2024
Технологии 12.02.2024
Аналитика 02.12.2021
Технологии 31.07.2019
Чтобы оставить комментарий или выставить рейтинг, нужно Войти или Зарегистрироваться
Читайте также